肿瘤模型动物实验服务
一、肿瘤模型动物实验服务
肿瘤疾病模型:
肿瘤动物模型可以分为皮下模型、人源肿瘤模型、转移模型、原位移植模型等。
1.1 皮下肿瘤模型(CDX)
CDX肿瘤模型(Cell line-Derived Xenograft, CDX)是将肿瘤细胞(或肿瘤组织)直接种植在小鼠的皮下而建立的一种肿瘤动物模型。该肿瘤模型是一种用于临床前评估药物体内药效的简单而重要的工具,同时,在肿瘤的发病机制、药物作用的研究中亦起到重要作用。
裸鼠(Balb/c 鼠,无毛发,T 淋巴细胞缺陷)是比较常见和常用的实验用鼠,尤其是在皮下移植瘤肿瘤模型的建立中起到重要作用。皮下移植肿瘤模型的优点是建立周期短、成瘤率高、易于操作、成本低,因此广泛地应用于生物医学研究与药物开发。当然,这种肿瘤模型也有缺陷,即不能很准确的模拟正常人体肿瘤发生发展的过程。
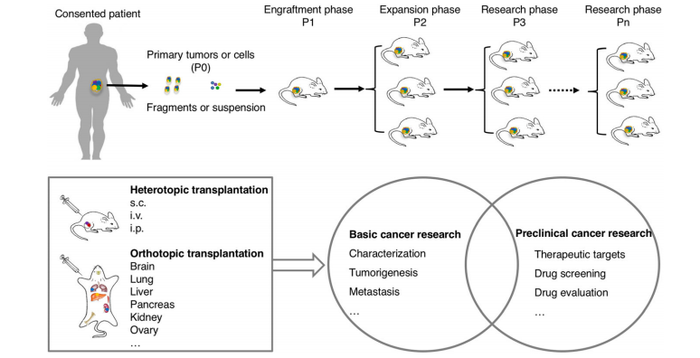
1.2 人源肿瘤异种移植模型(PDX)
人源肿瘤异种移植模型(Patient Derived Xenograft ,PDX)是指将手术病人的肿瘤组织切下来以后,接种在免疫缺陷的小鼠体内,在小鼠身上成瘤以后进一步传代以待后续研究。
近年来,随着肿瘤精准医学概念的提出,对PDX小鼠模型的需求和利用正日益扩大,尤其是借助于PDX小鼠模型进行肿瘤有效药物的筛选和评估,并逐步将其应用于临床上指导肿瘤患者的个体化治疗。PDX模型结合临床数据、基因组图谱以及药效数据可以增加药物特异性,应用于肿瘤患者个体化治疗,提高临床治疗成功率。
PDX模型的优点是保留了肿瘤患者的组织型和遗传学特征,并且维持了肿瘤的异质性。PDX模型能帮助科学家更好地研究肿瘤异质性和遗传复杂性,更深入探究肿瘤发生机制及发现潜在治疗靶点,还可以帮助预测患者对治疗药物可能产生的反应,包括疗效、毒副作用、吸收程度等,因此被广泛的应用到肿瘤药物研发当中。相比传统肿瘤细胞异种移植动物模型,应用PDX模型进行一些治疗方法临床应用潜力的评估会更加精确,它能提供更好的临床前药物疗效测试及分析。其缺点是样品资源较难以获得,建模周期比较长、成模率依疾病的不同而相差很大。
(Lai et al. Journal of Hematology & Oncology (2017) )
1.3 实验性肿瘤转移模型
实验性肿瘤转移模型为通过尾静脉注射肿瘤细胞后,肿瘤细胞在动物体内某个或某些器官形成肿瘤而建立的一种肿瘤模型。肿瘤转移是临床上肿瘤致死的最主要原因,然而肿瘤转移的机制和过程非常复杂,目前尚不完全清楚。建立转移模型,可以更好地模拟肿瘤在人身上的发生和发展过程,对药物筛选和开发的预测性更高。
肿瘤细胞经尾静脉注射后,先通过肺部的毛细血管网进入动脉血液循环系统,可造成全身多发转移灶。但是由于肿瘤细胞较为粘稠易聚团,一般会被困在小鼠肺部微血管,主要形成肺转移,可能后期会造成远端器官的转移。主要用于建立肿瘤转移(血行通路)模型或血癌模型或者肿瘤肺转移。
1.4 原位移植模型
原位移植指将肿瘤细胞或肿瘤组织块原位移植到免疫缺陷动物的组织器官内,使之产生肿瘤并形成自发性转移灶。
早期建立的动物移植瘤模型,移植瘤虽能维持来源肿瘤的组织结构和生化特性,但很少发生转移,从而影响了它在研究人类肿瘤转移特性方面的价值。进一步研究表明,人癌在宿主体内表达侵袭转移能力,不但需要具备合适的移植环境,而且还依赖于瘤细胞之间、瘤细胞与宿主之间的相互作用。近年来,根据原位移植理论建立起来的人癌瘤原位移植模型克服了这一缺陷,它不仅维持了原有瘤组织的结构,而且还保持了人体瘤的绝大部分生物学特性,特别是转移特性,它在宿主体内能以类似于患者体内的方式显示其恶性行为。在这一新型模型的启发下,建立的人类癌瘤的裸鼠原位移植瘤模型,为人类更好地研究肿瘤的转移机制提供了理想的工具。
为弥补异位移植方法的不足,避免假阳性结果的产生。对于所有实验性治疗方法来讲,最终都要应用原位移植瘤动物模型来更深一步研究其抗肿瘤谱及其分子生物学机制。对于细胞毒类药物,那些对肿瘤微环境起调控作用的抗肿瘤药物只可以在原位移植瘤动物模型上进行研究。如可以调节肿瘤细胞产物的化疗药物和可以调控机体局部组织反应的药物。如果想观察药物对转移性肿瘤的作用,最好应用原位裸鼠移植瘤动物模型进行研究。
本种模型的优点是目前较为理想的动物模型,为肿瘤的生长提供了最适宜的环境,能较好的模拟人体内肿瘤的发生、发展、侵袭及转移的全过程。但其缺点是制作过程较复杂,均一性较差,监控困难等。
(James E et al; Surg Res. J 2011)
1.5 自发性肿瘤模型
实验动物不经过人工处理而自然发生的一类肿瘤称之为自发性肿瘤。一般自发性肿瘤动物模型的获得,是通过对动物肿瘤进行大规模的普查,发现肿瘤的病例,然后通过选育,将这种自发性疾病模型保持下来,并培育成符合试验要求特征,以供研究。
自发性肿瘤发生的类型和发病率可随实验动物的种属、品系及类型的不同而各有差异。肿瘤实验研究中,一般应当选用高发病率的实验动物肿瘤模型作为研究对象。
自发性肿瘤型通常比用实验方法诱发的肿瘤与人类所患的肿瘤更为相似,有利于将动物实验结果推用到人。这一类肿瘤发生的条件比较自然,有可能通过细致观察和统计分析而发现原来没有发现的环境的或其它的致癌因素,可以着重观察遗传因素在肿瘤发生上的作用。但肿瘤的发生情况可能参差不齐,不可能在短时间内获得大量肿瘤学材料,观察时间可能较长,实验耗费较大。
总之,自发性肿瘤动物模型的优点:发病机制及机理较接近人。缺点:数量及种类非常有限,无法满足实验的需要。
1.6 诱发性肿瘤动物模型
诱发性肿瘤动物模型是以物理的、化学的或生物的致病因素造成动物组织、器官或全身一定的损害,出现类似人类疾病时功能、代谢或形态结构方面的改变称之为诱发性疾病动物模型。
实验肿瘤学研究常用本模型进行评价。常用于验证可疑致癌因素的作用,也越来越多地应用于肿瘤发生机理的研究及防治效果的观察上,在肿瘤病因学,遗传学,生物学等方面的研究中有重要地位。由于诱发因素和条件可人为控制,诱发率远高于自然发病率。
诱发性动物模型具有能在短时间内复制出大量疾病模型,并能严格控制各种条件使复制出的疾病模型适合研究目的需要等特点,因而为近代医学研究所用,特别是药物筛选研究工作所首选。
化学致癌物、射线或病毒均可在各类动物中诱发不同类型的肿瘤。以二甲基苯蒽(DMBA)为例,DMBA诱发大鼠乳腺癌试验为例,取鼠龄八周的SD雄鼠,单次灌喂麻油溶解DMBA20mg,肿瘤自60天开始生长,至120天癌发生率发病率很高。
优点:发病机制及机理也较接近人。缺点:几乎所有诱发剂对人体都有很大的毒性,对实验人员存在较大的风险;实验周期非常长,且诱发成功的时间不一致,无法在同一条件下大批量实验。
